(Αναδημοσίευση με μετάφραση από: National Cancer Institute (Εθνικό Ινστιτούτο Καρκίνου), “Medicinal Mushrooms (PDQ®)–Health Professional Edition”, https://www.cancer.gov/about-cancer/treatment/cam/hp/mushrooms-pdq)
Εισαγωγή
Τα φαρμακευτικά μανιτάρια χρησιμοποιούνται εδώ και εκατοντάδες χρόνια, κυρίως στις ασιατικές χώρες, για τη θεραπεία λοιμώξεων. Πιο πρόσφατα, έχουν χρησιμοποιηθεί επίσης στη θεραπεία πνευμονικών παθήσεων και καρκίνου. Τα φαρμακευτικά μανιτάρια έχουν εγκριθεί ως συμπλήρωμα των τυπικών θεραπειών για τον καρκίνο στην Ιαπωνία και την Κίνα για περισσότερα από 30 χρόνια και έχουν εκτεταμένο κλινικό ιστορικό ασφαλούς χρήσης ως μεμονωμένα φάρμακα ή σε συνδυασμό με ακτινοθεραπεία ή χημειοθεραπεία.
Στην Ασία χρησιμοποιούνται περισσότερα από 100 είδη φαρμακευτικών μανιταριών. Μερικά από τα πιο συχνά χρησιμοποιούμενα είδη περιλαμβάνουν τα ακόλουθα:
• Ganoderma lucidum (reishi)
• Trametes versicolor ή Coriolus versicolor (turkey tail)
• Lentinus edodes (shiitake)
• Grifola frondosa (maitake)
Μελέτες έχουν εξετάσει τις επιδράσεις των μανιταριών στα μονοπάτια της ανοσολογικής απόκρισης και στους άμεσους αντικαρκινικούς μηχανισμούς. Οι ανοσολογικές επιδράσεις μεσολαβούνται μέσω της διέγερσης των έμφυτων ανοσοκυττάρων από το μανιτάρι, όπως τα μονοκύτταρα, τα φυσικά κύτταρα φονείς και τα δενδριτικά κύτταρα. Η δραστηριότητα θεωρείται γενικά ότι προκαλείται από την παρουσία πολυσακχαριτών υψηλού μοριακού βάρους (βήτα-γλυκάνες) στα μανιτάρια, αν και μπορεί να εμπλέκονται και άλλα συστατικά. Κλινικές δοκιμές σε ασθενείς με καρκίνο έχουν δείξει ότι τα προϊόντα G. lucidum είναι γενικά καλά ανεκτά[*].
Αρκετές εταιρείες διανέμουν φαρμακευτικά μανιτάρια ως συμπληρώματα διατροφής. Στις ΗΠΑ, τα συμπληρώματα διατροφής ρυθμίζονται ως τρόφιμα και όχι ως φάρμακα. Ως εκ τούτου, δεν απαιτείται αξιολόγηση και έγκριση τέτοιων συμπληρωμάτων πριν από την κυκλοφορία στην αγορά από τον U.S. Food and Drug Administration (FDA) [ο ΕΟΦ των ΗΠΑ], εκτός εάν διατυπωθούν ειδικοί ισχυρισμοί πρόληψης ή θεραπείας ασθενειών. Επειδή τα συμπληρώματα διατροφής δεν ελέγχονται επίσημα ως προς την κατασκευαστική τους συνοχή, τα συστατικά μπορεί να διαφέρουν σημαντικά από παρτίδα σε παρτίδα και δεν υπάρχει καμία εγγύηση ότι τα συστατικά που αναφέρονται στις ετικέτες των προϊόντων υπάρχουν (ή υπάρχουν στις καθορισμένες ποσότητες). Ο FDA δεν έχει εγκρίνει τη χρήση φαρμακευτικών μανιταριών ως θεραπεία για τον καρκίνο ή οποιαδήποτε άλλη ιατρική πάθηση.
Πολλοί από τους ιατρικούς και επιστημονικούς όρους που χρησιμοποιούνται σε αυτήν την περίληψη υπάρχουν στο λεξικό Dictionary of Cancer Terms του NCI[**], το οποίο απευθύνεται σε μη ειδικούς.
Οι αναφορές αναφοράς σε ορισμένες περιλήψεις πληροφοριών για τον καρκίνο του PDQ μπορεί να περιλαμβάνουν συνδέσμους προς εξωτερικούς ιστότοπους που λειτουργούν από άτομα ή οργανισμούς με σκοπό την προώθηση ή την υποστήριξη της χρήσης συγκεκριμένων θεραπειών ή προϊόντων. Αυτές οι αναφορές αναφοράς περιλαμβάνονται μόνο για ενημερωτικούς σκοπούς. Η συμπερίληψή τους δεν θα πρέπει να θεωρείται ως έγκριση του περιεχομένου των ιστότοπων, ή οποιασδήποτε θεραπείας ή προϊόντος, από το PDQ Integrative, Alternative and Complementary Therapies Editorial Board ή το National Cancer Institute.
[*] Xingzhong Jin, Julieta Ruiz Beguerie, Daniel Man‐yuen Sze, Godfrey CF Chan and Cochrane Gynaecological, Neuro‐oncology and Orphan Cancer Group “Ganoderma lucidum (Reishi mushroom) for cancer treatment” (Ganoderma lucidum (μανιτάρι Reishi) για τη θεραπεία του καρκίνου) Cochrane Database Syst Rev. 2016 Apr;2016(4):CD007731.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6353236/
Περίληψη
“Ιστορικό: Το Ganoderma lucidum είναι ένα φυσικό φάρμακο που χρησιμοποιείται ευρέως και συνιστάται από Ασιάτες γιατρούς και φυσιοπαθητικούς για τα υποστηρικτικά του αποτελέσματα στο ανοσοποιητικό σύστημα. Εργαστηριακή έρευνα και μερικές προκλινικές δοκιμές έχουν δείξει ότι το G. lucidum φέρει πολλά υποσχόμενες αντικαρκινικές και ανοσοτροποποιητικές ιδιότητες. Η δημοτικότητα της λήψης του G. lucidum ως εναλλακτικού φαρμάκου έχει αυξηθεί σε ασθενείς με καρκίνο. Ωστόσο, δεν υπάρχει συστηματική ανασκόπηση που να έχει διεξαχθεί για την αξιολόγηση των πραγματικών οφελών του G. lucidum στη θεραπεία του καρκίνου.
Στόχοι: Να αξιολογήσει τις κλινικές επιδράσεις του G. lucidum στη μακροπρόθεσμη επιβίωση, την απόκριση του όγκου, τις ανοσολογικές λειτουργίες του ξενιστή και την ποιότητα ζωής σε ασθενείς με καρκίνο, καθώς και τις ανεπιθύμητες ενέργειες που σχετίζονται με τη χρήση του.
Μέθοδοι αναζήτησης: Αναζητήσαμε ένα εκτεταμένο σύνολο βάσεων δεδομένων, συμπεριλαμβανομένου των Cochrane Central Register of Controlled Trials (CENTRAL), MEDLINE, EMBASE, NIH, AMED, CBM, CNKI, CMCC και VIP Information/Chinese Scientific Journals Database για τυχαιοποιημένες ελεγχόμενες δοκιμές (RCTs) στον Οκτώβριο του 2011. Άλλες στρατηγικές που χρησιμοποιήθηκαν ήταν η σάρωση των παραπομπών των άρθρων που ανακτήθηκαν, η χειροκίνητη έρευνα του International Journal of Medicinal Mushrooms και η επαφή με ειδικούς στη φυτική ιατρική και παρασκευαστές G. lucidum. Για αυτήν την ενημέρωση ενημερώσαμε τις αναζητήσεις τον Φεβρουάριο του 2016.
Κριτήρια επιλογής: Για να είναι επιλέξιμες για να συμπεριληφθούν σε αυτήν την ανασκόπηση, οι μελέτες έπρεπε να είναι RCTs που να συγκρίνουν την αποτελεσματικότητα των φαρμάκων G. lucidum με τον ενεργό έλεγχο ή τον έλεγχο εικονικού φαρμάκου σε ασθενείς με καρκίνο που είχαν διαγνωστεί από παθολογία. Όλοι οι τύποι και τα στάδια καρκίνου ήταν επιλέξιμα για ένταξη. Οι δοκιμές δεν περιορίστηκαν με βάση την γλώσσα.
Συλλογή και ανάλυση δεδομένων: Πέντε RCTs πληρούσαν τα κριτήρια ένταξης και συμπεριλήφθηκαν σε αυτήν την ανασκόπηση. Δύο ανεξάρτητοι συγγραφείς αξιολόγησης αξιολόγησαν τη μεθοδολογική ποιότητα των μεμονωμένων δοκιμών. Συνήθη πρωτογενή αποτελέσματα ήταν η ανταπόκριση του όγκου που αξιολογήθηκε σύμφωνα με τα κριτήρια του Παγκόσμιου Οργανισμού Υγείας (ΠΟΥ), οι παράμετροι της ανοσολογικής λειτουργίας όπως η δραστηριότητα των φυσικών κυττάρων φονείς (NK) και τα υποσύνολα των συν-υποδοχέων των λεμφοκυττάρων και η ποιότητα ζωής που μετρήθηκε με τη βαθμολογία της κλίμακας Karnofsky . Καμία δοκιμή δεν είχε καταγράψει ποσοστά μακροπρόθεσμης επιβίωσης. Σε μία μελέτη αναφέρθηκαν σχετιζόμενες ανεπιθύμητες παρενέργειες. Πραγματοποιήθηκε μια μετα-ανάλυση για τη συγκέντρωση των διαθέσιμων δεδομένων από τις πρωτογενείς δοκιμές. Τα αποτελέσματα μετρήθηκαν χρησιμοποιώντας σχετικούς κινδύνους (RR) και τυπικές μέσες διαφορές (SMD) για διχοτομικά και συνεχή δεδομένα αντίστοιχα, με διάστημα εμπιστοσύνης 95% (CI).
Κύρια αποτελέσματα: Η μεθοδολογική ποιότητα των πρωτογενών μελετών ήταν γενικά μη ικανοποιητική και τα αποτελέσματα αναφέρθηκαν ανεπαρκώς από πολλές απόψεις. Πρόσθετες πληροφορίες δεν ήταν διαθέσιμες από τους βασικούς δοκιμαστές. Τα αποτελέσματα της μετα-ανάλυσης έδειξαν ότι οι ασθενείς στους οποίους είχε χορηγηθεί G. lucidum παράλληλα με χημειοθεραπεία / ακτινοθεραπεία ήταν πιο πιθανό να ανταποκριθούν θετικά σε σύγκριση με μόνο τη χημειοθεραπεία / ακτινοθεραπεία (RR 1,50; 95% CI 0,90 έως 2,51, P = 0,02). Η θεραπεία με G. lucidum από μόνη της δεν έδειξε το ίδιο ποσοστό παλινδρόμησης με αυτό που παρατηρείται στη συνδυασμένη θεραπεία. Τα αποτελέσματα για τους δείκτες της ανοσολογικής λειτουργίας του ξενιστή υποδηλώνουν ότι το G. lucidum αυξάνει ταυτόχρονα το ποσοστό των CD3, CD4 και CD8 κατά 3,91% (95% CI 1,92% σε 5,90%, P < 0,01), 3,05% (95% CI 1,00% σε 5,11 %, P < 0,01) και 2,02% (95% CI 0,21% έως 3,84%, P = 0,03), αντίστοιχα. Επιπλέον, η δραστηριότητα των λευκοκυττάρων, των ΝΚ-κυττάρων και η αναλογία CD4/CD8 ήταν οριακά αυξημένες. Τέσσερις μελέτες έδειξαν ότι οι ασθενείς στην ομάδα G. lucidum είχαν σχετικά βελτιωμένη ποιότητα ζωής σε σύγκριση με τους ελέγχους. Μια μελέτη κατέγραψε ελάχιστες παρενέργειες, συμπεριλαμβανομένης της ναυτίας και της αϋπνίας. Δεν αναφέρθηκε σημαντική αιματολογική ή ηπατική τοξικότητα.
Συμπεράσματα των συγγραφέων: Η ανασκόπησή μας δεν βρήκε επαρκή στοιχεία που να δικαιολογούν τη χρήση του G. lucidum ως θεραπείας πρώτης γραμμής για τον καρκίνο. Παραμένει αβέβαιο εάν το G. lucidum βοηθά στην παράταση της μακροπρόθεσμης επιβίωσης από τον καρκίνο. Ωστόσο, το G. lucidum θα μπορούσε να χορηγηθεί ως εναλλακτικό συμπλήρωμα της συμβατικής θεραπείας λαμβάνοντας υπόψη τη δυνατότητα του να ενισχύει την απόκριση του όγκου και να διεγείρει την ανοσία του ξενιστή. Το G. lucidum ήταν γενικά καλά ανεκτό από τους περισσότερους συμμετέχοντες με μόνο έναν διάσπαρτο αριθμό δευτερευόντων ανεπιθύμητων ενεργειών. Δεν παρατηρήθηκε σημαντική τοξικότητα σε όλες τις μελέτες. Αν και υπήρξαν λίγες αναφορές για επιβλαβή επίδραση του G. lucidum, η χρήση του εκχυλίσματος του θα πρέπει να είναι συνετή, ειδικά μετά από ενδελεχή εξέταση του κόστους-οφέλους και της προτίμησης του ασθενούς. Μελλοντικές μελέτες θα πρέπει να δώσουν έμφαση στη βελτίωση της μεθοδολογικής ποιότητας και απαιτείται περαιτέρω κλινική έρευνα για την επίδραση του G. lucidum στη μακροπρόθεσμη επιβίωση του καρκίνου. Μια ενημέρωση αυτής της αναθεώρησης θα πραγματοποιείται κάθε δύο χρόνια”.
[**] “NCI Dictionary of Cancer Terms” https://www.cancer.gov/publications/dictionaries/cancer-terms/
Το μανιτάρι Turkey Tail και ο Πολυσακχαρίτης-Κ (Polysaccharide-K)
Γενικές πληροφορίες
Το μανιτάρι Turkey tail είναι ένας ξυλώδης μύκητας πολύπορος που αναπτύσσεται σε νεκρούς κορμούς παγκοσμίως. Η επιστημονική ονομασία του μανιταριού Turkey tail είναι Trametes versicolor (L.) Lloyd, αν και ήταν γνωστό με άλλα ονόματα, κυρίως Coriolus versicolor (L. ex Fr.) Quel. Είναι γνωστό ως Yun Zhi στην παραδοσιακή κινεζική ιατρική και ως Kawaratake (μύκητας κεραμιδιών στέγης) στην Ιαπωνία. Το όνομα Turkey tail (ουρά γαλοπούλας) αναφέρεται στους ομόκεντρους δακτυλίους του σε καφέ και μαύρο, που μοιάζουν με τα φτερά της ουράς μιας γαλοπούλας. Υπάρχουν πολλά άλλα είδη Trametes, μερικά από τα οποία είναι δύσκολο να διακριθούν από το μανιτάρι Turkey tail. Οι εσωτερικές μεταγραμμένες αλληλουχίες διαχωριστή από μόνες τους έχουν βρεθεί ανεπαρκείς για τη διάκριση του μανιταριού Turkey tail από άλλα είδη Trametes, επομένως απαιτούνται πρόσθετοι μοριακοί χαρακτήρες για αυτήν την εργασία[1]. Ένα άλλο είδος Trametes που χρησιμοποιείται κυρίως στην Κίνα είναι το Trametes robiniophila Murr, γνωστό και ως Huaier.
Ιστορία
Ο μύκητας χρησιμοποιείται στην παραδοσιακή κινεζική ιατρική εδώ και πολλά χρόνια για τη θεραπεία πνευμονικών ασθενειών[2,3]. Ένα καθαρό εκχύλισμα ζεστού νερού που παρασκευάστηκε από το καλλιεργημένο μυκήλιο έχει χρησιμοποιηθεί στην Ιαπωνία για τις ανοσοτροποποιητικές του επιδράσεις ως επικουρική θεραπεία για τον καρκίνο[4-6]. Ο πολυσακχαρίτης-Κ (Polysaccharide-K, PSK) ή κρεστίνη (krestin), από το μανιτάρι T. versicolor, είναι ένα εγκεκριμένο προϊόν μανιταριού που χρησιμοποιείται για τη θεραπεία του καρκίνου στην Ιαπωνία. Ο PSK είναι ένα ιδιοσκεύασμα από την Kureha Corporation. Ο PSK έχει χρησιμοποιηθεί ως συμπληρωματική θεραπεία του καρκίνου σε χιλιάδες ασθενείς από τα μέσα της δεκαετίας του ‘70. Το ιστορικό ασφάλειας για τον PSK είναι καλά εδραιωμένο στην Ιαπωνία. Λίγες ανεπιθύμητες παρενέργειες έχουν αναφερθεί σε ασθενείς που έλαβαν θεραπεία με PSK. Το πολυσακχαροπεπτίδιο (Polysaccharopeptide, PSP) είναι ένα άλλο εκχύλισμα από το T. versicolor που παράγεται στην Κίνα.
Εργαστηριακές/Ζωικές/Προκλινικές Μελέτες
Χημεία
Το πιο γνωστό συστατικό του μανιταριού Turkey tail είναι το μείγμα γλυκοπρωτεϊνών γνωστό ως PSK. Ο PSK δεν είναι μια ομοιογενής ουσία, με ένα εύρος μοριακών βαρών κατά μέσο όρο 9,4 kDa (εύρος 5–300 kDa). Τα μόρια της γλυκοπρωτεΐνης αποτελούνται από μια κύρια αλυσίδα βήτα-(1,4) γλυκάνη με βήτα-(1,3)- και βήτα-(1,6)-συνδεδεμένες πλευρικές αλυσίδες. Μικρές ποσότητες γαλακτόζης (galactose), μαννόζης (mannose) και αραβινόζης (arabinose) έχουν επίσης ανιχνευθεί στο υδρόλυμα. Μεταξύ 25% και 38% της μάζας προέρχεται από μια ομοιοπολικά συνδεδεμένη πρωτεΐνη της οποίας η σύνθεση αμινοξέων έχει αναφερθεί[4].
Ο PSK ραδιοσημασμένος με άνθρακα C-14 έχει χρησιμοποιηθεί για τη μελέτη της από του στόματος βιοδιαθεσιμότητας και κατανομής του PSK σε ποντίκια, αρουραίους και κουνέλια. Ένα κλάσμα της δόσης φαίνεται να απορροφάται από το στόμα, περισσότερο ή λιγότερο άθικτο και απεκκρίνεται στη χολή για αρκετές ώρες. Ωστόσο, το μεγαλύτερο μέρος της ραδιοσημασμένης δόσης βρίσκεται στον εκπνεόμενο αέρα, υποδηλώνοντας ότι η πέψη του PSK μπορεί να συμβεί στο έντερο ή ο μεταβολισμός του απορροφημένου PSK μπορεί να συμβεί κάπου αλλού στο σώμα[7]. Έχει αναπτυχθεί ένα μονοκλωνικό αντίσωμα (ειδικό για PSK) που εξουδετερώνει τις αντικαρκινικές επιδράσεις του PSK. Έχει χρησιμοποιηθεί για την επικύρωση της παρουσίας PSK σε εμφυτευμένους όγκους[8].
Το PSP, μια πολύ παρόμοια ουσία, έχει επίσης καθαριστεί από μια διαφορετική ποικιλία του μανιταριού Turkey tail. Το PSP και ο PSK διαφέρουν κάπως στη σύνθεση του σακχάρου[2].
Ένα λιπιδικό συστατικό του PSK έχει διαχωριστεί με επεξεργασία με λιπάση και βρέθηκε ότι έχει δράση toll-like αγωνιστή του υποδοχέα 2, συνεργατική με τη συνδεδεμένη με την πρωτεΐνη βήτα-γλυκάνη. Το λιπιδικό συστατικό ήταν κυρίως λινολεϊκό οξύ, με μικρότερες ποσότητες άλλων λιπαρών οξέων[9].
Ο μη εκλεκτικός αναστολέας πρωτεϊνικής κινάσης υποθεμυκίνη[10] και το ανασταλτικό της συσσώρευσης λιπώδους λίπους κυκλικό πεπτίδιο ternatin[11] έχουν επίσης απομονωθεί από καλλιέργειες T. versicolor.
Μηχανιστικές μελέτες
Από τις πρώτες αναφορές κλινικών οφελών, άλλοι ερευνητές προσπάθησαν να ορίσουν τον μηχανισμό της ευεργετικής δράσης του PSK. Μια ομάδα υπέθεσε ότι η δυσλειτουργία των Τ-κυττάρων, συμπεριλαμβανομένης της απόπτωσης των Τ-κυττάρων του περιφερικού αίματος, εμφανίζεται συνήθως σε ασθενείς που λαμβάνουν χημειοθεραπεία[12]. Υπέθεσαν ότι η αναστροφή της δυσλειτουργίας των Τ-κυττάρων που προκαλείται από τη χημειοθεραπεία θα μπορούσε να μειώσει τις ανεπιθύμητες παρενέργειες ή να ενισχύσει το αντικαρκινικό αποτέλεσμα. Ο PSK αναφέρεται ότι ενισχύει τις δραστηριότητες των φυσικών κυττάρων φονείς (NK) και των Τ-κυττάρων μέσω της ανοδικής ρύθμισης της ιντερλευκίνης-2 ή της ιντερφερόνης-γάμα. Είκοσι ασθενείς με θεραπευτική εκτομή γαστρικού καρκίνου σταδίου ΙΙΙ χωρίστηκαν τυχαία για να λάβουν επικουρική θεραπεία με τη δεύτερης γενιάς ανασταλτική της διυδροπυριμιδίνης αφυδρογονάσης φθοριοπυριμιδίνη S-1 μόνη της (n = 10) ή S-1 συν PSK (n = 10). Στις 5 εβδομάδες μετά την επικουρική θεραπεία, η απόπτωση των Τ-κυττάρων ήταν σημαντικά υψηλότερη στην ομάδα S-1-μόνο από ότι στην ομάδα S-1-plus-PSK, οδηγώντας τους συγγραφείς στο συμπέρασμα ότι ο PSK θα μπορούσε εν μέρει να αποτρέψει την επαγόμενη απόπτωση των Τ-κυττάρων από S-1.
Μια άλλη ομάδα ερευνητών μελέτησε την επίδραση του PSK που προστέθηκε στη χημειοθεραπεία με τεγαφούρη/ουρακίλη (UFT) σε σύγκριση με εκείνη της UFT μόνο[13]. Οι βασικές ανοσιακές παράμετροι ήταν συγκρίσιμες στις δύο ομάδες. Ωστόσο, τα CD57-θετικά Τ-λεμφοκύτταρα μειώθηκαν πιο σημαντικά μετά τη χειρουργική επέμβαση για ασθενείς που έλαβαν PSK από ότι για εκείνους της ομάδας ελέγχου (P = 0,0486). Αυτοί οι ερευνητές είχαν σημειώσει προηγουμένως ότι ο υψηλός αριθμός CD57-θετικών κυττάρων ήταν δείκτης κακής πρόγνωσης σε ασθενείς με προχωρημένο γαστρικό καρκίνο, οδηγώντας τους να προτείνουν ότι ο PSK μπορεί να βελτιώσει τη συνολική επιβίωση (OS) εν μέρει αναστέλλοντας τα CD57-θετικά Τ κύτταρα.
Σημειώνοντας ότι οι ξενιστές καθίστανται ανοσοκατεσταλμένοι τη στιγμή της εξέλιξης του όγκου και ότι η μειωμένη έκφραση του μείζονος συμπλέγματος ιστοσυμβατότητας (MHC) κατηγορίας Ι από τον όγκο είναι ένας μηχανισμός που του επιτρέπει να αποφευχθεί η καταστροφή κυτταροτοξικών Τ λεμφοκυττάρων, οι ερευνητές διεξήγαγαν μια αναδρομική μελέτη για να αξιολογήσουν την έκφραση MHC κατηγορίας Ι με ανοσοϊστοχημική χρώση στις πρωτογενείς βλάβες ασθενών με γαστρικό καρκίνο σταδίου ΙΙ ή ΙΙΙ[14]. Ανέλυσαν δεδομένα από 349 ασθενείς που είχαν υποβληθεί σε επικουρική θεραπεία (μετά από θεραπευτική εκτομή) μεταξύ του 1995 και 2008. 225 ασθενείς έλαβαν επικουρική χημειοθεραπεία μόνο με από του στόματος φθοριοπυριμιδίνη, ενώ 124 ασθενείς έλαβαν επικουρική χημειοθεραπεία συν PSK 3g/ημέρα. Αν και αυτή δεν ήταν μια τυχαιοποιημένη δοκιμή, τα βασικά χαρακτηριστικά των ασθενών ταιριάστηκαν καλά. Η μέση διάρκεια της παρακολούθησης ήταν 49 μήνες. Τα ποσοστά τριετούς επιβίωσης χωρίς υποτροπή (RFS) ήταν τα ίδια και για τις δύο ομάδες (60% για την ομάδα PSK και 62% για την ομάδα μόνο χημειοθεραπείας). Για περιπτώσεις αρνητικής έκφρασης MHC, τα ποσοστά RFS 3 ετών ήταν 65% για την ομάδα PSK και 50% για την ομάδα μόνο χημειοθεραπείας, η διαφορά δεν θεωρήθηκε σημαντική. Για 82 ασθενείς με αρνητική έκφραση MHC με κατάσταση λεμφαδένων pN2 ή μεγαλύτερη, τα ποσοστά RFS ήταν 65% για την ομάδα PSK και 34% για την ομάδα μόνο χημειοθεραπείας – μια σημαντική διαφορά χωρίς προσφερόμενη τιμή P. Οι συγγραφείς κατέληξαν στο συμπέρασμα ότι η επικουρική ανοσοθεραπεία PSK μπορεί να είναι αποτελεσματική σε ασθενείς με MHC κατηγορίας I-αρνητικούς με προχωρημένη λεμφαδενική μετάσταση pN2 ή μεγαλύτερη.
Ενώ ο μηχανισμός δράσης για τον PSK γενικά και ειδικά για τον καρκίνο του παχέος εντέρου δεν είναι σαφώς καθορισμένος, η πιθανή δράση του PSK ως ανοσοτροποποιητικό συμπλήρωμα στη θεραπεία χημειοακτινοβολίας στον καρκίνο του ορθού έχει μελετηθεί. Τριάντα ασθενείς με καρκίνο του ορθού σταδίου ΙΙ ή ΙΙΙ που υποβλήθηκαν σε θεραπεία με S-1 και θεραπεία με εξωτερική ακτινοβολία κατανεμήθηκαν τυχαία για να λάβουν είτε το τυπικό σχήμα είτε το τυπικό σχήμα συν PSK. Ελέγχθηκε ένας αριθμός παραμέτρων κυτταρικής και χυμικής ανοσίας. Παρατηρήθηκε αύξηση στα κύτταρα ΝΚ περιφερικού αίματος μετά τη θεραπεία στην ομάδα που έλαβε PSK σε σύγκριση με την ομάδα ελέγχου. Τα επίπεδα ανοσοκατασταλτικής όξινης πρωτεΐνης (IAP) έχουν αναφερθεί ότι είναι αυξημένα σε ασθενείς με καρκίνο και συσχετίζονται με την εξέλιξη και την πρόγνωση του καρκίνου. Στη μελέτη, παρατηρήθηκε μια πιο αξιοσημείωτη μείωση του επιπέδου IAP σε ασθενείς που έλαβαν PSK από ότι σε εκείνους που έλαβαν θεραπεία στην ομάδα ελέγχου. Επιπλέον, τα κυτταροτοξικά Τ κύτταρα αυξήθηκαν στον περιογκικό βλεννογόνο και στον φυσιολογικό βλεννογόνο εντός του πεδίου ακτινοβολίας στην ομάδα που έλαβε PSK. Οι συγγραφείς της μελέτης κατέληξαν στο συμπέρασμα ότι η θεραπεία με PSK μπορεί να προάγει την τοπική ανοσία των ιστών εντός του πεδίου ακτινοβολίας.
Μια ανασκόπηση περιελάμβανε προκλινικές μελέτες που διεξήχθησαν σε μοντέλα καρκίνου του πνεύμονα χρησιμοποιώντας είτε PSK είτε άλλα σκευάσματα T. Versicolor[16]. Τα δεδομένα από τις 15 προκλινικές μελέτες υποστήριξαν τις αντικαρκινικές επιδράσεις του PSK μέσω ανοσοτροποποίησης και ενίσχυσης της ανοσολογικής επιτήρησης. Σε ζωικά μοντέλα, οι άμεσες αντικαρκινικές επιδράσεις είχαν ως αποτέλεσμα μειωμένη ανάπτυξη όγκου και μεταστάσεις.
Μελέτες σε ανθρώπους
Γαστρικός καρκίνος
Μελέτες παρατήρησης
Ο καρκίνος του στομάχου είναι η πιο κοινή κακοήθεια που διαγιγνώσκεται στην Κορέα. Οι ερευνητές στην Κορέα πραγματοποίησαν μια αναδρομική ανάλυση της επιβίωσης σε ασθενείς που έλαβαν PSK επιπλέον της χημειοθεραπείας και σε αυτούς που έλαβαν μόνο χημειοθεραπεία (ομάδα ελέγχου)[17]. Δυστυχώς, τα σχήματα χημειοθεραπείας διέφεραν στο ότι οι ασθενείς με PSK υποβλήθηκαν σε θεραπεία με φθοριοουρακίλη και μιτομυκίνη-C (207 ασθενείς), ενώ οι μάρτυρες έλαβαν φθοριοουρακίλη με χημειοθεραπεία με βάση τη δοξορουβικίνη (103 ασθενείς), εισάγοντας μια πιθανή μεροληψία στην ερμηνεία των αποτελεσμάτων. Στην ανάλυση συμπεριλήφθηκαν ασθενείς με όλα τα στάδια γαστρικού καρκίνου. Συνολικά, δεν υπήρχε διαφορά μεταξύ των ομάδων στα ποσοστά επιβίωσης χωρίς νόσο (DFS) 5 ετών ή επιβίωσης χωρίς εξέλιξη (PFS). Σε μια ανάλυση υποομάδας, οι λήπτες PSK με νόσο σταδίου ΙΒ ή σταδίου ΙΙ εμφάνισαν ανώτερη 5ετή επιβίωση (84,4% έναντι 67,6%· P = 0,019), αλλά δεν παρατηρήθηκε σημαντικό όφελος σε ασθενείς με νόσο υψηλότερου σταδίου.
Μια άλλη αναδρομική ανάλυση μη τυχαιοποιημένων δεδομένων αξιολόγησε 254 ασθενείς με γαστρικό καρκίνωμα που υποβλήθηκαν σε θεραπευτική χειρουργική επέμβαση με μετεγχειρητική επικουρική θεραπεία στην Ιαπωνία[18]. Οι ερευνητές συνέκριναν 139 ασθενείς που έλαβαν μόνο χημειοθεραπεία με 115 ασθενείς που έλαβαν χημειοθεραπεία συν PSK. Δεν υπήρχαν σημαντικές διαφορές μεταξύ των ομάδων στα δημογραφικά στοιχεία των ασθενών ή στα χαρακτηριστικά του όγκου κατά την έναρξη. Δεν υπήρχαν διαφορές μεταξύ των ομάδων στα ποσοστά 5ετούς RFS (52,7% στην ομάδα PSK και 52,7% στην ομάδα ελέγχου) ή στα ποσοστά 5 ετών OS (57,1% στην ομάδα PSK και 58,3% στην ομάδα ελέγχου). Σε μια ανάλυση υποομάδας ασθενών με περισσότερους από επτά εμπλεκόμενους λεμφαδένες (pN3), το ποσοστό OS 5 ετών ήταν σημαντικά υψηλότερο στην ομάδα PSK (47,8%) από ότι στην ομάδα ελέγχου (22,8%· P = 0,0317). Ως εκ τούτου, αυτά τα αποτελέσματα έρχονται σε αντίθεση με τα ευρήματα από την κορεατική ανάλυση.
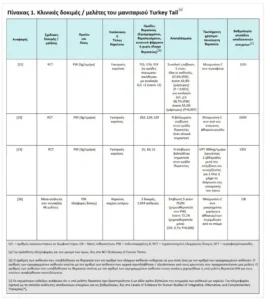
Κλινικές δοκιμές
Μια μελέτη που δημοσιεύθηκε το 1994 πρότεινε για πρώτη φορά το κλινικό όφελος του επικουρικού PSK για ασθενείς που υποβλήθηκαν σε θεραπευτική εκτομή του καρκίνου του στομάχου στην Ιαπωνία[19]. Οι ερευνητές ανέθεσαν τυχαία σε 262 ασθενείς που είχαν υποβληθεί σε θεραπευτική γαστρεκτομή για να λάβουν είτε τυπική θεραπεία με ενδοφλέβια μιτομυκίνη και φθοριοουρακίλη από του στόματος είτε χημειοθεραπεία συν δεσμευμένη σε πρωτεΐνη PSK. Οι ασθενείς παρακολουθήθηκαν για 5 έως 7 χρόνια. O PSK βελτίωσε τόσο το ποσοστό 5ετούς DFS (70,7% έναντι 59,4%· P = 0,047) όσο και το ποσοστό 5ετούς επιβίωσης (73,0% έναντι 60,0%· P = 0,044), σε σύγκριση με την τυπική ομάδα θεραπείας. Η θεραπεία με PSK ήταν καλά ανεκτή, με καλή συμμόρφωση. Οι συγγραφείς κατέληξαν στο συμπέρασμα ότι ο PSK θα πρέπει να προστεθεί στην τυπική χημειοθεραπεία για ασθενείς με καρκίνο του στομάχου που υποβάλλονται σε θεραπευτική γαστρεκτομή.
Μια μετα-ανάλυση του 2007 περιελάμβανε 8.009 ασθενείς από οκτώ τυχαιοποιημένες ελεγχόμενες δοκιμές (RCTs) επικουρικού PSK σε ασθενείς μετά από θεραπευτική εκτομή γαστρικών καρκίνων: 4.037 ασθενείς έλαβαν PSK με χημειοθεραπεία και 3.972 ασθενείς έλαβαν την ίδια χημειοθεραπεία μόνο. Ο λόγος κινδύνου OS ήταν 0,88 (95% διάστημα εμπιστοσύνης [CI], 0,79–0,98, P = 0,018), υποδεικνύοντας βελτιωμένη επιβίωση με την προσθήκη PSK, χωρίς σημαντική ετερογένεια μεταξύ των αποτελεσμάτων της θεραπείας που παρατηρήθηκαν στις διάφορες μελέτες. Οι τρεις δοκιμές με την καλύτερη ποιότητα υποστήριξαν τα ευρήματα από τις οκτώ μελέτες. Οι συγγραφείς κατέληξαν στο συμπέρασμα ότι ο PSK ήταν αποτελεσματικός ως επικουρική ανοσοθεραπεία για ασθενείς με καρκίνο του στομάχου και πρότειναν ότι αυτή η βελτίωση μπορεί να είναι τόσο στατιστικά όσο και κλινικά σημαντική.
Μια άλλη μεγάλη μελέτη που δεν συμπεριλήφθηκε σε αυτή τη μετα-ανάλυση ήταν μια ιαπωνική πολυκεντρική συγκριτική δοκιμή επικουρικής χημειοθεραπείας έναντι επικουρικής χημειοθεραπείας και PSK στην οποία συμμετείχαν 751 ασθενείς που υποβλήθηκαν σε θεραπευτική εκτομή.
από το 1978 έως το 1981[21]. Οι ασθενείς χωρίστηκαν τυχαία για να λάβουν είτε χημειοθεραπεία με mitomycin-C συν από του στόματος tegafur (επίσης γνωστή ως futraful) με (n = 377) ή χωρίς (n = 374) PSK 3g/ημέρα. Μετά από ανασκόπηση δεδομένων 20 ετών, οι ερευνητές στρωματοποίησαν τους ασθενείς με βάση την αναλογία των κοκκιοκυττάρων τους προς τα λεμφοκύτταρα (G/L), πιστεύοντας ότι οι αναλογίες G/L πάνω από 2,0 θα προέβλεπαν τους ανταποκρινόμενους. Τα ποσοστά OS 5 ετών ήταν 67,9% στην ομάδα PSK και 61,8% στην ομάδα ελέγχου (P = 0,053). Στην υποομάδα των 364 ασθενών με αναλογίες G/L πάνω από 2,0, τα ποσοστά 5ετούς επιβίωσης ήταν 68,7% στην ομάδα PSK και 55,4% στην ομάδα ελέγχου (P = 0,007). Επειδή η αναλογία G/L δεν σχετιζόταν με το στάδιο, οι συγγραφείς πρότειναν ότι η αναλογία G/L μπορεί να είναι ένας παράγοντας που εξαρτάται από τον ξενιστή και μπορεί να είναι χρήσιμος για την πρόβλεψη του ποιος θα μπορούσε να ανταποκριθεί καλύτερα στον ανοσοενισχυτικό PSK.
Τέλος, μια άλλη μικρή μελέτη έχει αναφερθεί μετά τη μετα-ανάλυση[13]. Οι ασθενείς έλαβαν είτε από του στόματος UFT 300 mg/ημέρα ή UFT συν PSK 3g/ημέρα για τουλάχιστον 1 χρόνο μετά από γαστρική εκτομή για γαστρικό καρκίνο σταδίου ΙΙ ή ΙΙΙ. Το ποσοστό 3ετούς επιβίωσης ήταν 62,2% στους 10 ασθενείς που έλαβαν PSK και 12,5% στους 11 ασθενείς που έλαβαν μόνο UFT (P = 0,038).
Καρκίνος του μαστού
Μέχρι στιγμής, μελέτες που έχουν αναφέρει τη χρήση προϊόντων T. versicolor σε ασθενείς με καρκίνο του μαστού έχουν επικεντρωθεί στην τεκμηρίωση αλλαγών στις παραμέτρους του ανοσοποιητικού (πχ. αλλαγές σε υποσύνολα Τ-κυττάρων και αριθμό Β-κυττάρων στο αίμα) σε αντίθεση με τις κλινικές παραμέτρους (πχ. επιβίωση ασθενούς, επίλυση συμπτωμάτων/παρενεργειών ή βελτίωση της ποιότητας ζωής)[22,23].
Καρκίνος παχέος εντέρου
Μελέτες παρατήρησης
Μια αναδρομική μελέτη της επιβίωσης 63 ασθενών με καρκίνο του παχέος εντέρου που ήταν μεγαλύτεροι από 70 ετών και έλαβαν θεραπεία με UFT με ή χωρίς PSK συμπεριέλαβε 24 ασθενείς που έλαβαν UFT συν PSK. Τα ποσοστά επιβίωσης 3 ετών χωρίς υποτροπή ήταν 76,2% στην ομάδα PSK και 47,8% στην ομάδα μόνο με UFT (μάρτυρας) και τα ποσοστά 3 ετών OS ήταν 80,8% στην ομάδα PSK και 52,8% στην ομάδα ελέγχου[24].
Μια μελέτη ανέλυσε τα αποτελέσματα από 101 ασθενείς σε ένα μεμονωμένο ίδρυμα στην Ιαπωνία που είχαν καρκίνο του παχέος εντέρου Dukes B ή Dukes C και έλαβαν θεραπεία με UFT ή UFT συν PSK για 24 μήνες μετά από θεραπευτική επέμβαση. Αυτοί οι ασθενείς παρακολουθούνταν για έως και 10 χρόνια μετά την επέμβαση[25]. Η 10ετής επιβίωση ήταν σημαντικά καλύτερη για τους ασθενείς που έλαβαν θεραπεία με PSK, με αναλογία κινδύνου 0,3.
Κλινικές δοκιμές
Κλινικές μελέτες του PSK στον καρκίνο του παχέος εντέρου έχουν δείξει μείωση της υποτροπής και βελτίωση της OS με επικουρική χρήση.
Μια μετα-ανάλυση τυχαιοποιημένων, κεντρικά εκχωρημένων, προοπτικών κλινικών δοκιμών επικουρικής θεραπείας με PSK που δημοσιεύθηκε μεταξύ 1980 και 2004 εντόπισε τρεις κλινικές δοκιμές που πληρούσαν κριτήρια επιλογής που κάλυπταν 1.094 ασθενείς[26]. Συνδυάζοντας τα δεδομένα και από τις τρεις δοκιμές, οι ερευνητές διαπίστωσαν ότι ο εκτιμώμενος λόγος πιθανοτήτων (OR) για τα ακόλουθα:
• Το 5ετές DFS ήταν 0,72 (95% CI, 0,58–0,90, P = 0,003, ευνοώντας τον PSK).
• Η OS 5 ετών ήταν 0,71 (95% CI, 0,55–0,90, P = 0,006, ευνοώντας τον PSK).
Καρκίνος του πνεύμονα
Κλινικές δοκιμές
Τριάντα μία αναφορές 28 μελετών συμπεριλήφθηκαν σε μια συστηματική ανασκόπηση του PSK στον καρκίνο του πνεύμονα[16]:
• Δεκαεπτά προκλινικές μελέτες.
• Πέντε μη τυχαιοποιημένες ελεγχόμενες δοκιμές.
• Έξι RCTs.
Και οι πέντε μη τυχαιοποιημένες ελεγχόμενες δοκιμές ανέφεραν βελτιωμένη διάμεση επιβίωση με τη χρήση PSK σε συνδυασμό με συμβατική ακτινοθεραπεία ή/και χημειοθεραπεία. PSK 3g/ημέρα με ταυτόχρονη χημειοθεραπεία χρησιμοποιήθηκε σε όλες τις RCTs και και οι έξι μελέτες έδειξαν όφελος για τουλάχιστον ένα από τα ακόλουθα καταληκτικά σημεία:
• Μέτρα ανοσοποιητικής λειτουργίας
• Σωματικό βάρος
• Κατάσταση απόδοσης
• Συμπτώματα που σχετίζονται με τον όγκο
• Επιβίωση
[*] https://www.cancer.gov/publications/pdq/levels-evidence/cam
Βιβλιογραφικές αναφορές
- [1]. Carlson A, Justo A, Hibbett DS: Species delimitation in Trametes: a comparison of ITS, RPB1, RPB2 and TEF1 gene phylogenies. Mycologia 106 (4): 735-45, 2014 Jul-Aug.
- [2]. Ng TB: A review of research on the protein-bound polysaccharide (polysaccharopeptide, PSP) from the mushroom Coriolus versicolor (Basidiomycetes: Polyporaceae). Gen Pharmacol 30 (1): 1-4, 1998.
- [3]. Ying J, Mao X, Ma Q, et al.: Icons of Medicinal Fungi from China. Science Press, 1987.
- [4]. Tsukagoshi S, Hashimoto Y, Fujii G, et al.: Krestin (PSK). Cancer Treat Rev 11 (2): 131-55, 1984.
- [5]. Cui J, Chisti Y: Polysaccharopeptides of Coriolus versicolor: physiological activity, uses, and production. Biotechnol Adv 21 (2): 109-22, 2003.
- [6]. Sakagami H, Aoki T, Simpson A, et al.: Induction of immunopotentiation activity by a protein-bound polysaccharide, PSK (review). Anticancer Res 11 (2): 993-9, 1991 Mar-Apr.
- [7]. Ikuzawa M, Matsunaga K, Nishiyama S, et al.: Fate and distribution of an antitumor protein-bound polysaccharide PSK (Krestin). Int J Immunopharmacol 10 (4): 415-23, 1988.
- [8]. Hoshi H, Saito H, Iijima H, et al.: Anti-protein-bound polysaccharide-K monoclonal antibody binds the active structure and neutralizes direct antitumor action of the compound. Oncol Rep 25 (4): 905-13, 2011.
- [9]. Quayle K, Coy C, Standish L, et al.: The TLR2 agonist in polysaccharide-K is a structurally distinct lipid which acts synergistically with the protein-bound β-glucan. J Nat Med 69 (2): 198-208, 2015.
- [10]. Miller RM, Taunton J: Targeting protein kinases with selective and semipromiscuous covalent inhibitors. Methods Enzymol 548: 93-116, 2014.
- [11]. Miller R, Galitsky NM, Duax WL, et al.: Molecular structures of two crystalline forms of the cyclic heptapeptide antibiotic ternatin, cyclo[-beta-OH-D-Leu-D-Ile-(NMe)Ala-(NMe)Leu-Leu-(NMe)Ala-D-(NMe)Ala-]. Int J Pept Protein Res 42 (6): 539-49, 1993.
- [12]. Kono K, Kawaguchi Y, Mizukami Y, et al.: Protein-bound polysaccharide K partially prevents apoptosis of circulating T cells induced by anti-cancer drug S-1 in patients with gastric cancer. Oncology 74 (3-4): 143-9, 2008.
- [13]. Akagi J, Baba H: PSK may suppress CD57(+) T cells to improve survival of advanced gastric cancer patients. Int J Clin Oncol 15 (2): 145-52, 2010.
- [14]. Ito G, Tanaka H, Ohira M, et al.: Correlation between efficacy of PSK postoperative adjuvant immunochemotherapy for gastric cancer and expression of MHC class I. Exp Ther Med 3 (6): 925-930, 2012.
- [15]. Sadahiro S, Suzuki T, Maeda Y, et al.: Effects of preoperative immunochemoradiotherapy and chemoradiotherapy on immune responses in patients with rectal adenocarcinoma. Anticancer Res 30 (3): 993-9, 2010.
- [16]. Fritz H, Kennedy DA, Ishii M, et al.: Polysaccharide K and Coriolus versicolor extracts for lung cancer: a systematic review. Integr Cancer Ther 14 (3): 201-11, 2015.
- [17]. Choi JH, Kim YB, Lim HY, et al.: 5-fluorouracil, mitomycin-C, and polysaccharide-K adjuvant chemoimmunotherapy for locally advanced gastric cancer: the prognostic significance of frequent perineural invasion. Hepatogastroenterology 54 (73): 290-7, 2007 Jan-Feb.
- [18]. Tanaka H, Muguruma K, Ohira M, et al.: Impact of adjuvant immunochemotherapy using protein-bound polysaccharide-K on overall survival of patients with gastric cancer. Anticancer Res 32 (8): 3427-33, 2012.
- [19]. Nakazato H, Koike A, Saji S, et al.: Efficacy of immunochemotherapy as adjuvant treatment after curative resection of gastric cancer. Study Group of Immunochemotherapy with PSK for Gastric Cancer. Lancet 343 (8906): 1122-6, 1994.
- [20]. Oba K, Teramukai S, Kobayashi M, et al.: Efficacy of adjuvant immunochemotherapy with polysaccharide K for patients with curative resections of gastric cancer. Cancer Immunol Immunother 56 (6): 905-11, 2007.
- [21]. Toge T, Yamaguchi Y: Protein-bound polysaccharide increases survival in resected gastric cancer cases stratified with a preoperative granulocyte and lymphocyte count. Oncol Rep 7 (5): 1157-61, 2000 Sep-Oct.
- [22]. Wong CK, Bao YX, Wong EL, et al.: Immunomodulatory activities of Yunzhi and Danshen in post-treatment breast cancer patients. Am J Chin Med 33 (3): 381-95, 2005.
- [23]. Torkelson CJ, Sweet E, Martzen MR, et al.: Phase 1 Clinical Trial of Trametes versicolor in Women with Breast Cancer. ISRN Oncol 2012: 251632, 2012.
- [24]. Yoshitani S, Takashima S: Efficacy of postoperative UFT (Tegafur/Uracil) plus PSK therapies in elderly patients with resected colorectal cancer. Cancer Biother Radiopharm 24 (1): 35-40, 2009.
- [25]. Sakai T, Yamashita Y, Maekawa T, et al.: Immunochemotherapy with PSK and fluoropyrimidines improves long-term prognosis for curatively resected colorectal cancer. Cancer Biother Radiopharm 23 (4): 461-7, 2008.
- [26]. Sakamoto J, Morita S, Oba K, et al.: Efficacy of adjuvant immunochemotherapy with polysaccharide K for patients with curatively resected colorectal cancer: a meta-analysis of centrally randomized controlled clinical trials. Cancer Immunol Immunother 55 (4): 404-11, 2006.
Reishi (Ganoderma lucidum)
Γενικές πληροφορίες
Το Ganoderma είναι ένα γένος ξυλωδών πολύπορων μυκήτων που αναπτύσσονται σε ζωντανά δέντρα. Στην Κινεζική Φαρμακοποιία, τα επίσημα είδη είναι το Ganoderma lucidum (Leyss. ex Fr.) P. Karst και το Ganoderma sinense Zhao, Xu et Zhang. Ένα άλλο είδος που συναντάται συχνά είναι το Ganoderma lingzhi Wu, Cao et Dai. Στην παραδοσιακή κινεζική ιατρική, αυτοί οι μύκητες είναι συλλογικά γνωστοί ως Ling Zhi. στην Ιαπωνία, είναι γνωστοί ως Reishi. Στην Κίνα, το G. lucidum είναι γνωστό ως Chizhi και το G. sinense είναι γνωστό ως Zizhi.
Πρόσφατες μοριακές ταξινομικές και χημικές μελέτες κατέστησαν σαφές ότι το αρχικά περιγραφόμενο ευρωπαϊκό είδος G. lucidum και το φαρμακευτικό είδος της Ανατολικής Ασίας δεν είναι πανομοιότυπα[1-5]. Το πρόσφατα αποδεκτό όνομα για το είδος της Ανατολικής Ασίας που παραδοσιακά ονομάζεται G. lucidum είναι Ganoderma sichuanense. Ωστόσο, οι περισσότερες έρευνες παγκοσμίως έχουν δημοσιευτεί με το όνομα G. lucidum. Αυτό περιλαμβάνει την πλήρη αλληλουχία γονιδιώματος του G. Lucidum[6]. Υπάρχουν πολλά άλλα είδη Ganoderma, τα οποία είναι δύσκολο να διακριθούν από τα φαρμακευτικά είδη[5].
Ιστορία
Το Ganoderma έχει πολύ μεγάλη ιστορία στην Ανατολική Ασία ως φαρμακευτικό μανιτάρι που χρονολογείται από την κινεζική materia medica “Shen Nung Ben Cao Jing”, που γράφτηκε μεταξύ 206 π.Χ. και 8 μ.Χ. Θεωρήθηκε ανώτερο τονωτικό για την παράταση της ζωής, την πρόληψη της γήρανσης και την ενίσχυση του τσι. Έχει συνδεθεί με την αριστοκρατία, ίσως λόγω της σπανιότητας του στην άγρια φύση. Ήταν επίσης σεβαστό στην ιαπωνική κουλτούρα. Χρησιμοποιείται από σύγχρονους Κινέζους γιατρούς για την υποστήριξη της λειτουργίας του ανοσοποιητικού σε ασθενείς που υποβάλλονται σε χημειοθεραπεία ή ακτινοθεραπεία για καρκίνο, μεταξύ άλλων χρήσεων[7]. Σε ορισμένα μέρη του κόσμου (πχ. Σαγκάη), οι καρκινοπαθείς συνήθως χρησιμοποιούν συμπληρώματα που περιέχουν Ganoderma lucidum[8]. Η ανάπτυξη βελτιωμένων προϊόντων Ganoderma βρίσκεται επί του παρόντος σε εξέλιξη χρησιμοποιώντας βιοτεχνολογικές διαδικασίες[9].
Εργαστηριακές/Ζωικές/Προκλινικές Μελέτες
Χημεία
Μεταξύ των βιολογικά ενεργών συστατικών του G. lucidum είναι τα τριτερπενοειδή, οι πολυσακχαρίτες, τα λιπίδια και οι πρωτεΐνες[10-12]. Οι περισσότερες εργαστηριακές ερευνητικές μελέτες έχουν χρησιμοποιήσει προϊόντα G. lucidum που λαμβάνονται μέσω οποιασδήποτε από τις διάφορες διαδικασίες εκχύλισης, τα οποία παράγουν προϊόντα που περιέχουν μείγμα δύο ή περισσότερα από αυτά τα μοριακά είδη. Αυτή η έλλειψη καθαρότητας των υπό μελέτη προϊόντων μπορεί να ευθύνεται για ορισμένες από τις αλληλεπικαλύψεις βιολογικών δραστηριοτήτων που αποδίδονται στα επιμέρους συστατικά.
Οι καλύτερα μελετημένοι πολυσακχαρίτες Ganoderma διαθέτουν κυρίως 1,3- και 1,4-γλυκοσιδικούς δεσμούς, οι οποίοι είναι υψηλού μοριακού βάρους[10]. Οι βήτα-γλυκάνες είναι γνωστό ότι συνδέονται με τον υποδοχέα του συμπληρώματος CR3[13]. Η δραστηριότητα θεωρείται ότι είναι ανοσοτροποποιητικής φύσης, παρόμοια με πολλούς άλλους φαρμακευτικούς μύκητες. Πρόσφατα επισημάνθηκε ότι τα προϊόντα Ganoderma που προέρχονται από μυκήλιο που αναπτύσσεται σε διαφορετικά υποστρώματα κόκκων περιέχουν μεγάλες ποσότητες άλφα-γλυκανών που προέρχονται από το υπόστρωμα, σε σύγκριση με το καρποφόρο σώμα και τα εκχυλίσματα του, τα οποία είναι εξ ολοκλήρου βήτα-γλυκάνης στη φύση[14].
Πολλά είδη Ganoderma παράγουν μεγάλες ποσότητες οξειδωμένων τριτερπενίων λανοστανίου (oxidized lanostane triterpenes) σε ένα σύνθετο μείγμα. Τα τριτερπένια Ganoderma είναι μοναδικά για το γένος. Ορισμένα τριτερπένια G. lucidum έχουν βρεθεί ότι αναστέλλουν την ανάπτυξη των καρκινικών κυτταρικών σειρών, αν και πολλά από τα κύρια τριτερπένια είναι σχετικά ασθενείς αναστολείς ή ανενεργά[18,19]. Ο μεταβολισμός των τριτερπενίων στα θηλαστικά έχει μελετηθεί μεμονωμένα και σε συνδυασμό, με πολυάριθμες θέσεις μεταβολισμού που έχουν εντοπιστεί[20].
Μελέτες in vitro
Πολλά προϊόντα που προέρχονται από το G. lucidum έχουν μελετηθεί σε προκλινικά μοντέλα και έχουν αναφερθεί ότι παράγουν αντικαρκινικά αποτελέσματα. Τόσο τα τριτερπενοειδή όσο και οι πολυσακχαρίτες προκαλούν διακοπή της κυτταρικής ανάπτυξης και κυτταροτοξικότητα[21-30]. Μελέτες της κυτταρικής οδού μέσω της οποίας τα τριτερπενοειδή του G. lucidum παράγουν κυτταροτοξικότητα έχουν γενικά εμπλέκονται οδούς απόπτωσης, τόσο την εγγενή όσο και τη μιτοχονδριακή οδό[21,23-25,27] και η εξωτερική οδός ή ο υποδοχέας του θανάτωσης[29]. Τα τριτερπενοειδή αναστέλλουν επίσης την προσκόλληση και τη μετανάστευση των κακοήθων κυττάρων[22,32,32].
Πολυσακχαρίτες από το G. lucidum έχει αποδειχθεί ότι επάγουν την ωρίμανση των δενδριτικών κυττάρων, αυξάνοντας έτσι την πιθανότητα αυτά τα προϊόντα να υποστηρίξουν ή να προκαλέσουν ανοσο-μεσολαβούμενες αντικαρκινικές δράσεις[35].
Άλλοι δυνητικοί μηχανισμοί αντικαρκινικής δράσης έχουν αποδειχθεί, συμπεριλαμβανομένων αναφορών για την επαγωγή διαφοροποίησης των κυττάρων νευροβλαστώματος in vitro[36] και την αναστολή της κυτταρικής έκκρισης παραγόντων που σχετίζονται με την επαγόμενη από όγκους αγγειογένεση, όπως ο αγγειακός ενδοθηλιακός αυξητικός παράγοντας (VEGF) και μετασχηματιστικός αυξητικός παράγοντας (TGF)-βήτα[37].
Το γανοδερενικό οξύ Β (ganoderenic acid B), ένα τριτερπένιο που προέρχεται από το G. lucidum, έχει αποδειχθεί ότι ενισχύει την κυτταροτοξικότητα των χημειοθεραπευτικών παραγόντων σε μια ανθεκτική στα φάρμακα κυτταρική σειρά ηπατοκυτταρικού καρκινώματος αναστέλλοντας τη λειτουργία μεταφοράς της κασέτας δέσμευσης τριφωσφορικής αδενοσίνης (ATP) (ABC) μεταφορείς[38]. Αυτό το εύρημα οδήγησε τους ερευνητές στο συμπέρασμα ότι το γανοδερενικό οξύ Β μπορεί να έχει τη δυνατότητα να αναπτυχθεί σε παράγοντα αναστροφής της αντοχής σε πολλά φάρμακα.
Μελέτες in vivo
Σχετικά λίγες μελέτες έχουν διερευνήσει τις in vivo επιδράσεις του G. lucidum σε ζωικά μοντέλα, αλλά οι διαθέσιμες έχουν δείξει αντικαρκινική δράση τριτερπενοειδών σε ποντικούς που φέρουν καρκίνωμα πνεύμονα Lewis[39] και αντικαρκινικές επιδράσεις πολυσακχαριτών σε ποντίκια που φέρουν κύτταρα S180[40] και Ehrlich ασκιτικά κύτταρα[41].
Μελέτες σε ανθρώπους
Καρκίνος του πνεύμονα
Μηχανιστικές μελέτες
Δεν υπάρχουν μελέτες για το G. lucidum με μετρημένα αποτελέσματα καρκίνου. Βασιζόμενοι στις προκλινικές ενδείξεις ότι τα κλάσματα πολυσακχαρίτη του G. lucidum ενισχύουν την ανοσολογική λειτουργία του ξενιστή και έχουν πιθανή αντινεοπλασματική δράση, οι ερευνητές μελέτησαν ένα προϊόν χωρίς ιατρική συνταγή σε ασθενείς με καρκίνο του πνεύμονα προχωρημένου σταδίου[42]. Οι ασθενείς έλαβαν Ganopoly, ένα υδατικό κλάσμα πολυσακχαρίτη που εκχυλίστηκε από καρποφόρα σώματα G. lucidum. Σε μια ανοιχτή δοκιμή, εγγράφηκαν 36 ασθενείς με προχωρημένο καρκίνο του πνεύμονα σε νοσοκομείο στην Κίνα και 30 ήταν προσβάσιμοι για ανοσολογική λειτουργία μετά από 12 εβδομάδες. Οι ασθενείς υποβλήθηκαν σε χημειοθεραπεία ή ακτινοθεραπεία και άλλες συμπληρωματικές θεραπείες. Το Ganopoly χορηγήθηκε ως κάψουλες 1.800mg 3 φορές την ημέρα πριν από τα γεύματα για 12 εβδομάδες. Η θεραπεία δεν άλλαξε σημαντικά τη μέση μιτογόνο αντιδραστικότητα στη φυτοαιμοσυγκολλητίνη, μέσες μετρήσεις λεμφοκυττάρων υποομάδων CD3, CD4, CD8 και CD56. Μέσες συγκεντρώσεις στο πλάσμα στην ιντερλευκίνη-2, ιντερλευκίνη-6 ή ιντερφερόνη-γάμα. ή φυσική δραστηριότητα φονικών κυττάρων (P > 0,05). Οι ερευνητές σημείωσαν ότι ορισμένοι ασθενείς όντως παρουσίασαν κάποιες σημαντικές αλλαγές στις παραμέτρους που μελετήθηκαν, αλλά η επίδραση της ομάδας ήταν μηδενική συνολικά.
Μια άλλη μηχανιστική μελέτη στην Κίνα διερεύνησε εάν οι πολυσακχαρίτες G. lucidum θα μπορούσαν να εξουδετερώσουν την ανοσοκαταστολή που προκαλείται σε πλάσμα ασθενών με καρκίνο του πνεύμονα[43]. Υπάρχει η υπόθεση ότι τα καρκινικά κύτταρα απελευθερώνουν ανοσοκατασταλτικούς μεσολαβητές όπως PGE2, TGF-βήτα, IL-10 και VEGF για να αναστείλουν την ανοσοαπόκριση και να διαφύγουν από την ανοσολογική επιτήρηση. Οι πολυσακχαρίτες G. lucidum είχαν αποδειχθεί ότι εξουδετερώνουν αυτήν την ανοσοκαταστολή σε ένα μοντέλο ζωικής κυτταρικής καλλιέργειας. Ως εκ τούτου, αυτό το πείραμα πραγματοποιήθηκε για να αξιολογηθεί εάν το αποτέλεσμα θα μπορούσε να επαναληφθεί στους ανθρώπους. Λήφθηκε αίμα από 12 ασθενείς με καρκίνο του πνεύμονα. Οι πολυσακχαρίτες G. lucidum απομονώθηκαν από ένα εκχύλισμα ζέοντος νερού καρπών σωμάτων G. lucidum με καθίζηση με αιθανόλη. Η έκφραση CD69 σε μονοπύρηνα λεμφοκύτταρα μετά από διέγερση φυτοαιμοσυγκολλητίνης αναστέλλεται σημαντικά σε σύγκριση με τους ελέγχους (P = 0,05) μετά από 24ωρη επώαση με πλάσμα ασθενών με καρκίνο του πνεύμονα. Οι πολυσακχαρίτες G. lucidum σε συγκεντρώσεις 3,2μg/mL και 12,8μg/mL ανταγωνίστηκαν σημαντικά αυτήν την αναστολή (P < 0,05 και για τα δύο). Παρόμοια αποτελέσματα παρατηρήθηκαν με πρόσθετες αναλύσεις που οδηγούν τους ερευνητές στο συμπέρασμα ότι η επαγόμενη από το πλάσμα καταστολή της ενεργοποίησης των λεμφοκυττάρων από τη φυτοαιμοσυγκολλητίνη σε ασθενείς με καρκίνο του πνεύμονα μπορεί να ανταγωνίζεται πλήρως ή εν μέρει τους πολυσακχαρίτες G. lucidum, καθιστώντας τους ένα ελκυστικό πρόσθετο στη θεραπεία του καρκίνου.
Καρκίνος παχέος εντέρου
Πρόληψη
Ιάπωνες ερευνητές μελέτησαν ένα υδατοδιαλυτό εκχύλισμα από ένα καλλιεργημένο μέσο G. lucidum mycelia (MAK) σε ασθενείς με ορθοκολικά αδενώματα[44]. Αφού διαγνώστηκαν με αδενώματα παχέος εντέρου στην κολονοσκόπηση, 123 ασθενείς εγγράφηκαν στην ομάδα θεραπείας MAK και 102 μάρτυρες χωρίς θεραπεία επιλέχθηκαν τυχαία από τους ασθενείς του τμήματος. Στην ομάδα θεραπείας χορηγήθηκε 1,5g/d MAK για 12 μήνες. Και οι δύο ομάδες υποβλήθηκαν σε επαναληπτική κολονοσκόπηση στους 12 μήνες. Η αλλαγή στον αριθμό των αδενωμάτων ήταν +0,66 +/- 0,10 στην ομάδα ελέγχου και -0,42 +/- 0,10 στην ομάδα που υποβλήθηκε σε θεραπεία (Ρ < 0,01). Το συνολικό μέγεθος των αδενωμάτων αυξήθηκε κατά 1,73 +/- 0,28 mm στην ομάδα ελέγχου και μειώθηκε κατά -1,40 +/- 0,64 mm στην ομάδα MAK (Ρ < 0,01). Αυτά τα αποτελέσματα υποδηλώνουν ότι το MAK μπορεί να καταστέλλει την ανάπτυξη προκακοήθων αδενωμάτων του παχέος εντέρου.
Βιβλιογραφικές αναφορές
- [1]. Raja HA, Baker TR, Little JG, et al.: DNA barcoding for identification of consumer-relevant mushrooms: A partial solution for product certification? Food Chem 214: 383-92, 2017.
- [2]. Hennicke F, Cheikh-Ali Z, Liebisch T, et al.: Distinguishing commercially grown Ganoderma lucidum from Ganoderma lingzhi from Europe and East Asia on the basis of morphology, molecular phylogeny, and triterpenic acid profiles. Phytochemistry 127: 29-37, 2016.
- [3]. Zhang X, Xu Z, Pei H, et al.: Intraspecific Variation and Phylogenetic Relationships Are Revealed by ITS1 Secondary Structure Analysis and Single-Nucleotide Polymorphism in Ganoderma lucidum. PLoS One 12 (1): e0169042, 2017.
- [4]. Liao B, Chen X, Han J, et al.: Identification of commercial Ganoderma (Lingzhi) species by ITS2 sequences. Chin Med 10: 22, 2015.
- [5]. Hong SG, Jung HS: Phylogenetic analysis of Ganoderma based on nearly complete mitochondrial small-subunit ribosomal DNA sequences. Mycologia 96 (4): 742-55, 2004 Jul-Aug.
- [6]. Chen S, Xu J, Liu C, et al.: Genome sequence of the model medicinal mushroom Ganoderma lucidum. Nat Commun 3: 913, 2012.
- [7]. Upton R, ed.: Reishi Mushroom: Ganoderma Lucidum: Standards of Analysis, Quality Control, and Therapeutics. American Herbal Pharmacopoeia, 2000.
- [8]. Bao PP, Lu W, Cui Y, et al.: Ginseng and Ganoderma lucidum use after breast cancer diagnosis and quality of life: a report from the Shanghai Breast Cancer Survival Study. PLoS One 7 (6): e39343, 2012.
- [9]. Boh B: Ganoderma lucidum: a potential for biotechnological production of anti-cancer and immunomodulatory drugs. Recent Pat Anticancer Drug Discov 8 (3): 255-87, 2013.
- [10]. Ferreira IC, Heleno SA, Reis FS, et al.: Chemical features of Ganoderma polysaccharides with antioxidant, antitumor and antimicrobial activities. Phytochemistry 114: 38-55, 2015.
- [11]. Baby S, Johnson AJ, Govindan B: Secondary metabolites from Ganoderma. Phytochemistry 114: 66-101, 2015.
- [12]. Xia Q, Zhang H, Sun X, et al.: A comprehensive review of the structure elucidation and biological activity of triterpenoids from Ganoderma spp. Molecules 19 (11): 17478-535, 2014.
- [13]. Yan J, Vetvicka V, Xia Y, et al.: Beta-glucan, a “specific” biologic response modifier that uses antibodies to target tumors for cytotoxic recognition by leukocyte complement receptor type 3 (CD11b/CD18). J Immunol 163 (6): 3045-52, 1999.
- [14]. Chilton J: A new analytical fingerprinting system for quality control of medicinal mushroom products. In: Baars JJP, Sonnenberg ASM, eds.: Science and Cultivation of Edible and Medicinal Fungi: Mushroom Science XIX. Proceedings of the 19th Congress of the International Society for Mushroom Science. International Society for Mushroom Science, 2016, pp 267-71. Also available onlineExit Disclaimer. Last accessed April 24, 2017.
- [15]. Cheng CR, Yue QX, Wu ZY, et al.: Cytotoxic triterpenoids from Ganoderma lucidum. Phytochemistry 71 (13): 1579-85, 2010.
- [16]. Wu GS, Guo JJ, Bao JL, et al.: Anti-cancer properties of triterpenoids isolated from Ganoderma lucidum – a review. Expert Opin Investig Drugs 22 (8): 981-92, 2013.
- [17]. Chen S, Li X, Yong T, et al.: Cytotoxic lanostane-type triterpenoids from the fruiting bodies of Ganoderma lucidum and their structure-activity relationships. Oncotarget 8 (6): 10071-10084, 2017.
- [18]. Da J, Cheng CR, Yao S, et al.: A reproducible analytical system based on the multi-component analysis of triterpene acids in Ganoderma lucidum. Phytochemistry 114: 146-54, 2015.
- [19]. Qi Y, Zhao L, Sun HH: Development of a rapid and confirmatory method to identify ganoderic acids in ganoderma mushrooms. Front Pharmacol 3: 85, 2012.
- [20]. Cheng CR, Yang M, Yu K, et al.: Metabolite identification of crude extract from Ganoderma lucidum in rats using ultra-performance liquid chromatography-quadrupole time-of-flight mass spectrometry. J Chromatogr B Analyt Technol Biomed Life Sci 941: 90-9, 2013.
- [21]. Shang D, Li Y, Wang C, et al.: A novel polysaccharide from Se-enriched Ganoderma lucidum induces apoptosis of human breast cancer cells. Oncol Rep 25 (1): 267-72, 2011.
- [22]. Jiang J, Grieb B, Thyagarajan A, et al.: Ganoderic acids suppress growth and invasive behavior of breast cancer cells by modulating AP-1 and NF-kappaB signaling. Int J Mol Med 21 (5): 577-84, 2008.
- [23]. Liu RM, Zhong JJ: Ganoderic acid Mf and S induce mitochondria mediated apoptosis in human cervical carcinoma HeLa cells. Phytomedicine 18 (5): 349-55, 2011.
- [24]. Liang ZE, Yi YJ, Guo YT, et al.: Inhibition of migration and induction of apoptosis in LoVo human colon cancer cells by polysaccharides from Ganoderma lucidum. Mol Med Rep 12 (5): 7629-36, 2015.
- [25]. Liang Z, Yi Y, Guo Y, et al.: Chemical characterization and antitumor activities of polysaccharide extracted from Ganoderma lucidum. Int J Mol Sci 15 (5): 9103-16, 2014.
- [26]. Hsieh TC, Wu JM: Regulation of cell cycle transition and induction of apoptosis in HL-60 leukemia cells by the combination of Coriolus versicolor and Ganoderma lucidum. Int J Mol Med 32 (1): 251-7, 2013.
- [27]. Hsu CL, Yu YS, Yen GC: Lucidenic acid B induces apoptosis in human leukemia cells via a mitochondria-mediated pathway. J Agric Food Chem 56 (11): 3973-80, 2008.
- [28]. Ruan W, Wei Y, Popovich DG: Distinct Responses of Cytotoxic Ganoderma lucidum Triterpenoids in Human Carcinoma Cells. Phytother Res 29 (11): 1744-52, 2015.
- [29]. Zaidman BZ, Wasser SP, Nevo E, et al.: Androgen receptor-dependent and -independent mechanisms mediate Ganoderma lucidum activities in LNCaP prostate cancer cells. Int J Oncol 31 (4): 959-67, 2007.
- [30]. Wang T, Xie ZP, Huang ZS, et al.: Total triterpenoids from Ganoderma Lucidum suppresses prostate cancer cell growth by inducing growth arrest and apoptosis. J Huazhong Univ Sci Technolog Med Sci 35 (5): 736-41, 2015.
- [31]. Wu GS, Song YL, Yin ZQ, et al.: Ganoderiol A-enriched extract suppresses migration and adhesion of MDA-MB-231 cells by inhibiting FAK-SRC-paxillin cascade pathway. PLoS One 8 (10): e76620, 2013.
- [32]. Weng CJ, Chau CF, Hsieh YS, et al.: Lucidenic acid inhibits PMA-induced invasion of human hepatoma cells through inactivating MAPK/ERK signal transduction pathway and reducing binding activities of NF-kappaB and AP-1. Carcinogenesis 29 (1): 147-56, 2008.
- [33]. Liang C, Li H, Zhou H, et al.: Recombinant Lz-8 from Ganoderma lucidum induces endoplasmic reticulum stress-mediated autophagic cell death in SGC-7901 human gastric cancer cells. Oncol Rep 27 (4): 1079-89, 2012.
- [34]. Wang JH, Zhou YJ, Zhang M, et al.: Active lipids of Ganoderma lucidum spores-induced apoptosis in human leukemia THP-1 cells via MAPK and PI3K pathways. J Ethnopharmacol 139 (2): 582-9, 2012.
- [35]. Chan WK, Cheung CC, Law HK, et al.: Ganoderma lucidum polysaccharides can induce human monocytic leukemia cells into dendritic cells with immuno-stimulatory function. J Hematol Oncol 1: 9, 2008.
- [36]. Pinweha S, Wanikiat P, Sanvarinda Y, et al.: The signaling cascades of Ganoderma lucidum extracts in stimulating non-amyloidogenic protein secretion in human neuroblastoma SH-SY5Y cell lines. Neurosci Lett 448 (1): 62-6, 2008.
- [37]. Stanley G, Harvey K, Slivova V, et al.: Ganoderma lucidum suppresses angiogenesis through the inhibition of secretion of VEGF and TGF-beta1 from prostate cancer cells. Biochem Biophys Res Commun 330 (1): 46-52, 2005.
- [38]. Liu DL, Li YJ, Yang DH, et al.: Ganoderma lucidum derived ganoderenic acid B reverses ABCB1-mediated multidrug resistance in HepG2/ADM cells. Int J Oncol 46 (5): 2029-38, 2015.
- [39]. Qu D, He J, Liu C, et al.: Triterpene-loaded microemulsion using Coix lacryma-jobi seed extract as oil phase for enhanced antitumor efficacy: preparation and in vivo evaluation. Int J Nanomedicine 9: 109-19, 2014.
- [40]. Li YB, Wang R, Wu HL, et al.: Serum amyloid A mediates the inhibitory effect of Ganoderma lucidum polysaccharides on tumor cell adhesion to endothelial cells. Oncol Rep 20 (3): 549-56, 2008.
- 41. Joseph S, Sabulal B, George V, et al.: Antitumor and anti-inflammatory activities of polysaccharides isolated from Ganoderma lucidum. Acta Pharm 61 (3): 335-42, 2011.
- [42]. Gao Y, Tang W, Dai X, et al.: Effects of water-soluble Ganoderma lucidum polysaccharides on the immune functions of patients with advanced lung cancer. J Med Food 8 (2): 159-68, 2005.
- [43]. Sun LX, Li WD, Lin ZB, et al.: Protection against lung cancer patient plasma-induced lymphocyte suppression by Ganoderma lucidum polysaccharides. Cell Physiol Biochem 33 (2): 289-99, 2014.
- [44]. Oka S, Tanaka S, Yoshida S, et al.: A water-soluble extract from culture medium of Ganoderma lucidum mycelia suppresses the development of colorectal adenomas. Hiroshima J Med Sci 59 (1): 1-6, 2010.
Περίληψη των αποδεικτικών στοιχείων για τα φαρμακευτικά μανιτάρια
Για να βοηθηθούν οι αναγνώστες στην αξιολόγηση των αποτελεσμάτων των ανθρώπινων μελετών για ολοκληρωμένες, εναλλακτικές και συμπληρωματικές θεραπείες για τον καρκίνο, παρέχεται όποτε είναι δυνατό η ισχύς των αποδεικτικών στοιχείων (δηλαδή των επιπέδων αποδείξεων) που σχετίζονται με κάθε τύπο θεραπείας. Για να πληροί τις προϋποθέσεις για ανάλυση επιπέδου αποδεικτικών στοιχείων, μια μελέτη πρέπει να:
• Δημοσιεύεται σε επιστημονικό περιοδικό με κριτές.
• Αναφέρετε ένα θεραπευτικό αποτέλεσμα ή συνέπεια, όπως η ανταπόκριση του όγκου, η βελτίωση της επιβίωσης ή η μετρούμενη βελτίωση της ποιότητας ζωής.
• Περιγράφει τα κλινικά ευρήματα με επαρκή λεπτομέρεια ώστε να μπορεί να γίνει μια ουσιαστική αξιολόγηση.
Ξεχωριστά επίπεδα βαθμολογιών αποδεικτικών στοιχείων αποδίδονται σε μελέτες που πληρούν τις προϋποθέσεις για ανθρώπους με βάση τη στατιστική ισχύ του σχεδιασμού της μελέτης και την επιστημονική ισχύ των αποτελεσμάτων της θεραπείας (δηλαδή, των τελικών σημείων) που μετρήθηκαν. Οι δύο βαθμολογίες που προκύπτουν συνδυάζονται στη συνέχεια για να παραχθεί μια συνολική βαθμολογία. Για μια επεξήγηση των βαθμολογιών και πρόσθετες πληροφορίες σχετικά με τα επίπεδα ανάλυσης αποδεικτικών στοιχείων των ολοκληρωμένων, εναλλακτικών και συμπληρωματικών θεραπειών για τον καρκίνο, δες στο ανατρέξτε στο Levels of Evidence for Human Studies of Integrative, Alternative, and Complementary Therapies https://www.cancer.gov/publications/pdq/levels-evidence/cam
Σχετικά με αυτήν τη σύνοψη PDQ
Σκοπός αυτής της περίληψης
Αυτή η σύνοψη πληροφοριών για τον καρκίνο του PDQ για επαγγελματίες υγείας παρέχει ολοκληρωμένες, αξιολογημένες από ομοτίμους, βασισμένες σε στοιχεία πληροφορίες σχετικά με τη χρήση φαρμακευτικών μανιταριών στη θεραπεία ατόμων με καρκίνο. Προορίζεται ως πηγή ενημέρωσης και βοήθειας των κλινικών γιατρών στη φροντίδα των ασθενών τους. Δεν παρέχει επίσημες οδηγίες ή συστάσεις για τη λήψη αποφάσεων υγειονομικής περίθαλψης.
Αναθεωρητές και ενημερώσεις
Αυτή η περίληψη επανεξετάζεται τακτικά και ενημερώνεται όπως απαιτείται από την επιτροπή PDQ Integrative, Alternative, and Complementary Therapies Editorial Board, η οποία είναι συντακτική επιτροπή ανεξάρτητη από το National Cancer Institute (NCI). Η περίληψη αντικατοπτρίζει μια ανεξάρτητη ανασκόπηση της βιβλιογραφίας και δεν αντιπροσωπεύει δήλωση πολιτικής του NCI ή των National Institutes of Health (NIH).
Τα μέλη του διοικητικού συμβουλίου εξετάζουν τα πρόσφατα δημοσιευμένα άρθρα κάθε μήνα για να καθορίσουν εάν ένα άρθρο πρέπει:
• να συζητηθεί σε μια συνάντηση,
• να αναφέρεται με κείμενο ή
• αντικαταστήσει ή ενημερώσει ένα υπάρχον άρθρο που αναφέρεται ήδη.
Οι αλλαγές στις περιλήψεις πραγματοποιούνται μέσω μιας διαδικασίας συναίνεσης κατά την οποία τα μέλη του διοικητικού συμβουλίου αξιολογούν την ισχύ των αποδεικτικών στοιχείων στα δημοσιευμένα άρθρα και καθορίζουν πώς το άρθρο πρέπει να συμπεριληφθεί στη σύνοψη.
Οποιαδήποτε σχόλια ή ερωτήσεις σχετικά με το περιεχόμενο της περίληψης θα πρέπει να υποβάλλονται στο Cancer.gov μέσω του email του ιστότοπου NCI. Μην επικοινωνείτε με τα μεμονωμένα μέλη του ΔΣ με ερωτήσεις ή σχόλια σχετικά με τις περιλήψεις. Τα μέλη του διοικητικού συμβουλίου δεν θα απαντήσουν σε μεμονωμένες ερωτήσεις.
Επίπεδα Απόδειξης
Ορισμένες από τις αναφορές αναφοράς σε αυτήν την περίληψη συνοδεύονται από προσδιορισμό επιπέδου αποδεικτικών στοιχείων. Αυτοί οι χαρακτηρισμοί προορίζονται να βοηθήσουν τους αναγνώστες να αξιολογήσουν την ισχύ των αποδεικτικών στοιχείων που υποστηρίζουν τη χρήση συγκεκριμένων παρεμβάσεων ή προσεγγίσεων. Η PDQ Integrative, Alternative, and Complementary Therapies Editorial Board χρησιμοποιεί ένα επίσημο σύστημα κατάταξης αποδεικτικών στοιχείων για την ανάπτυξη των ονομασιών του σε επίπεδο αποδεικτικών στοιχείων.